美国医疗,首个PD-L1免疫疗法药物在美获批!
据我国出国看病的旗舰品牌盛诺一家介绍,2016年5月18日,首个PD-L1抑制剂Tecentriq(atezolizumab)获得美国食品药品监督管理局(以下简称FDA)批准,用于治疗最常见的膀胱癌,即膀胱尿路上皮癌。
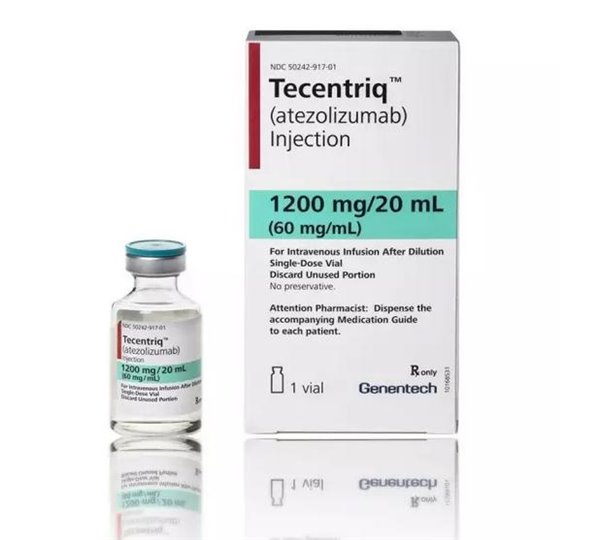
2016年5月18日,首个PD-L1抑制剂Tecentriq(atezolizumab)获得美国食品药品监督管理局(以下简称FDA)批准,用于治疗最常见的膀胱癌,即膀胱尿路上皮癌。与Tecentriq同时获批的还有用于检测PD-L1蛋白表达水平的诊断性检查VentanaPD-L1 (SP142)检测试剂盒。
“Tecentriq为膀胱尿路上皮癌患者提供了一种靶向PD-L1通路的新疗法,”FDA药品评价与研究中心的血液与肿瘤药品办公室主任RichardPazdur博士说。“阻断PD-1/PD-L1相互作用的药物是人类不断探究免疫系统与癌细胞相互作用所取得的成果。”
PD-1和PD-L1是存在于人体免疫细胞和某些癌细胞中的蛋白质,而Tecentriq可以通过阻断PD-1/PD-L1相互作用来帮助人体免疫系统抗击癌细胞。Tecentriq是获FDA批准的首个PD-L1抑制剂,同时也是过去两年里获FDA批准的最新一款PD-1/PD-L1靶向生物制剂。
Tecentriq获批用于治疗在铂类化疗期间或铂类化疗后或者在手术治疗前后接受铂类化疗12个月内病情恶化的局部晚期或转移性膀胱尿路上皮癌患者。膀胱尿路上皮癌产生于泌尿系统,可累及膀胱和相关器官,是最常见的膀胱癌类型。据美国国家癌症研究所预计,2016年美国将有76,960名新增膀胱癌病例和16,390名膀胱癌死亡病例。
一项单臂临床试验评估了Tecentriq治疗局部晚期或转移性膀胱尿路上皮癌患者的安全性与有效性。该试验测定了达到肿瘤完全消失或部分缩小的患者的比例(即客观有效率),同时还研究了基于患者的肿瘤浸润性免疫细胞是否表达PD-L1蛋白(“阳性”vs.“阴性”)的疗效差异。该试验共入组310名患者,其中14.8%的患者至少达到了肿瘤部分缩小,且该疗效持续了2.1个月以上到13.8个月以上。在PD-L1表达阳性患者中,26%的患者达到了肿瘤缓解;相比之下,在PD-L1表达阴性患者中,只有9.5%的患者达到了肿瘤缓解。
由此可见,Tecentriq对PD-L1表达阳性患者的疗效优于PD-L1表达阴性患者。这表明患者肿瘤浸润性免疫细胞中的PD-L1表达水平可能有助于确定哪些患者更有可能对Tecentriq治疗产生反应。因此,VentanaPD-L1 (SP142)检测试剂盒也同时获得FDA批准,用于检测患者肿瘤浸润性免疫细胞中的PD-L1蛋白表达水平和帮助医生确定哪些患者可能会从Tecentriq治疗中获益最多。
Tencentriq的最常见副作用是疲劳、食欲减退、恶心、泌尿系统感染、发热和便秘。Tencentriq对人体免疫系统的影响还有可能导致感染和严重的副作用,即免疫介导的器官损伤,侵及的健康器官包括肺、结肠和内分泌系统。
FDA授予了Tencentriq突破性疗法认定、优先审批资格和加速审批资格。这些独特审批程序旨在根据新药对重大或威胁生命疾病的治疗潜力来促进并加快新药的研发与审批工作。
Tecentriq由总部设在美国加州旧金山的基因泰克公司推广上市。VentanaPD-L1 (SP142)检测试剂盒由位于美国亚利桑那州图森的罗氏集团成员Ventana医疗集团推广上市。
盛诺一家是我国最早开创、同时也是规模最大的海外医疗服务机构,与美国、日本、英国等发达国家20家医院正式签订了合作转诊协议,将以自身专业、规范的服务,为患者筛选最好、最适合的医疗机构,并通过与患者签订就诊协议,保障患者的合法权益。
声明:东方联盟网站刊登/转载此文出于传递更多信息之目的,并不意味着赞同其观点或论证其描述。
- 01-092023年的四大网络风险以及如何应对
- 01-09操作系统/虚拟化安全知识域:攻击者模型
- 01-09操作系统/虚拟化安全知识域:操作系统及其设计在安全中的作用
- 01-092022年全球勒索赎金TOP 10
- 03-06俄乌冲突快讯:乌克兰网站被攻击数量超十倍
- 02-23开放式银行创新:开发人员与网络犯罪分子之间的竞赛
- 02-23数据泄露后信息会怎样?
- 02-23四个首创 冬奥网络安全“黑科技”面面观
- 01-11全球最受赞誉公司揭晓:苹果连续九年第一
- 12-09罗伯特·莫里斯:让黑客真正变黑
- 12-09谁闯入了中国网络?揭秘美国绝密黑客小组TA
- 12-09警示:iOS6 惊现“闪退”BUG
- 11-18LG新能源宣布与Bear Robotics达成合作,成为
- 11-18机构:三季度全球个人智能音频设备市场强势
- 11-18闲鱼:注册用户过6亿 AI技术已应用于闲置交
- 11-18美柚、宝宝树回应“涉黄短信骚扰”:未发现
- 11-01京东七鲜与前置仓完成融合












 粤公网安备 44060402001498号
粤公网安备 44060402001498号